广告
炎症是一种重要的防御系统,在生物体中进化以增强生存能力。炎症的常见诱因是感染和组织损伤(Medzhitov 2008)。空气污染、水质差和其他环境因素也会引发和维持炎症。
Medzhitov解释说,炎症反应是身体试图恢复自身稳态的一种平衡状态,在这种状态下,细胞参数,如葡萄糖和氧气,都在可接受的范围内。血液是所有消炎药的输送系统。炎症包括巨噬细胞(包围并杀死微生物并清除死亡细胞的白细胞)、白细胞(攻击外来物质和疾病的白细胞)以及各种其他细胞成分(Chung等人,2019年)。
第一道防线是短期急性炎症,其中免疫细胞、抗炎剂和组织重塑过程对抗组织损伤或危险物质(即抗原,如过敏原、毒素或病原体)(Chung et al. 2019)。
慢性炎症与慢性疾病
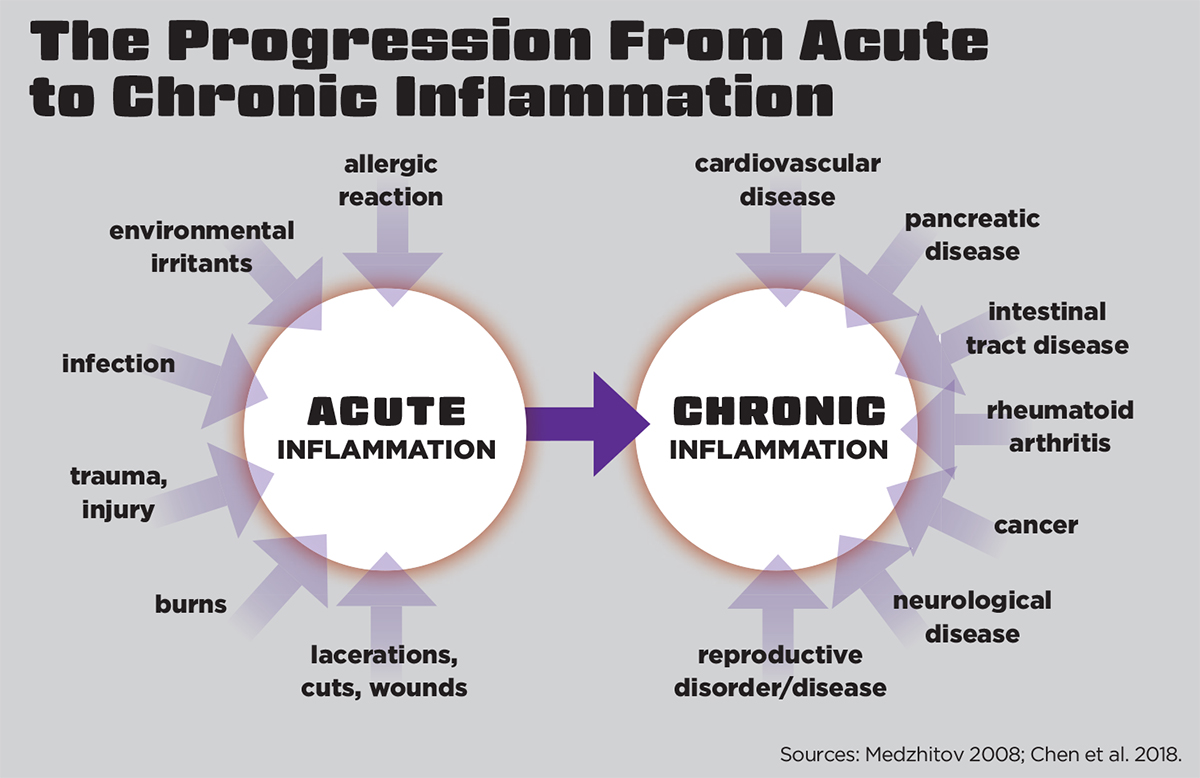
急性炎症是至关重要的,但当急性炎症反应不能解决有害的细胞入侵时,问题就出现了。更多的防御成分被动员起来,导致一种持续的、低等级的、长期的免疫反应慢性炎症以及一系列潜在的严重健康挑战(见下面的“从急性到慢性炎症的进展”)。
Libby(2007)总结了慢性炎症途径对许多慢性疾病的发展起决定性作用的有力证据。本文将首先关注慢性低度炎症与肥胖、2型糖尿病和衰老之间的关系。然后将回顾运动如何对抗慢性炎症。
Obesity-Induced炎症
大多数人生活在超重和肥胖的国家肥胖比体重过轻害死的人还多。2016年,全球成年人口中约有11%的男性和15%的女性被认为肥胖。可悲的是,世界上5岁以下的儿童中有3800万是儿童肥胖或超重(世卫组织2020a)。
临床上,过度积累脂肪组织(脂肪)有助于高血压、动脉粥样硬化、2型糖尿病、高胆固醇血症、非酒精性脂肪性肝病、胆囊疾病、关节炎、阿尔茨海默病和癌症的发展(Ferrante 2007)。白色脂肪组织不再被认为是仅用于能量储存的惰性组织(Ellulu et al. 2017),肥胖和炎症之间的关系引发了一些有趣的研究。
参见:食物与炎症的联系
脂肪和炎症:基础知识
脂肪组织由脂肪细胞(储存脂肪的地方)、前脂肪细胞和各种其他类型的免疫细胞组成(Boutens & Stienstra 2016)。
脂肪组织储存在皮下(皮肤以下)和内脏(内部器官周围)储存库。流行病学证据表明,内脏脂肪量是代谢异常(包括胰岛素抵抗)发生的主要危险因素(Boutens & Stienstra 2016)。
脂肪细胞
研究表明,在细胞水平上,肥胖会改变脂肪组织结构。肥胖会导致由脂肪细胞产生的免疫细胞的组成和数量的改变。结果是与胰岛素抵抗和2型糖尿病相关的低度炎症(Boutens & Stienstra 2016)。
随着肥胖脂肪细胞继续扩大,这些脂肪细胞的血供减少,导致缺氧(低血氧),从而导致内皮功能障碍(Ellulu et al. 2017)。Ellulu及其同事表明,内皮功能障碍是危险的,因为它增加了大动脉的血管收缩反应,负责向活跃组织供应含氧血液。
脂肪因子和细胞因子
脂肪组织中的免疫细胞产生和分泌多种脂肪因子。脂肪因子是一种激素家族,具有促进和抗炎作用,促进与其他参与饱腹感(饱腹感)和能量调节的细胞和组织的交流新陈代谢(Boutens & Stienstra 2016)。
有趣的是,早期研究表明,与瘦人相比,肥胖者体内炎症标志物的循环浓度更高。
随着肥胖的发展,脂肪组织开始储存过量的甘油三酯,这可以改变脂肪因子和脂肪的释放细胞因子(对控制其他免疫系统细胞的生长和活性至关重要的小蛋白质)。这种不平衡的释放会导致系统性的炎症过程,从而干扰胰岛素信号。
Boutens & Stienstra进一步解释,实验表明,与皮下脂肪相比,由细胞因子释放决定的炎症状态在内脏脂肪中升高。
肥胖已被发现增加分泌肿瘤坏死因子-一种影响全身脂质和葡萄糖代谢的炎性细胞因子。肥胖还可能增加十多个产生炎症蛋白的基因的表达(即基因中编码的信息用于指导蛋白质分子组装的过程)(Ferrante 2007)。
此外,生产过剩白细胞介素- 6(IL-6,一种强大的促炎细胞因子)与脂联素的降低有关。脂联素是一种重要的蛋白质激素,可减轻炎症和动脉硬化。此外,过量的IL-6刺激血管沿线的细胞产生和分泌c反应蛋白。高水平的c反应蛋白表明慢性炎症状态、感染和冠心病风险(Ellulu et al. 2017)。
与炎症的许多因素一样,平衡很重要,正如你将在下面关于运动和IL-6的讨论中看到的那样。
巨噬细胞
巨噬细胞是一种白细胞,通过清除细胞碎片来维持组织内稳态,在脂肪组织功能和慢性炎症中起着关键作用。在瘦人体内,巨噬细胞约占脂肪组织细胞的5%。但在肥胖患者中,巨噬细胞可构成所有脂肪组织细胞的50% (Boutens & Stienstra 2016),并且它们持续暴露在过剩的脂质中。
这种巨噬细胞的超载导致这些细胞功能障碍,结果是脂肪组织的慢性炎症(Ferrante 2007)。科学家们刚刚开始了解肥胖期间发生的巨噬细胞代谢(Boutens & Stienstra 2016)。
炎症,2型糖尿病和糖尿病
对健康的主要影响2型糖尿病糖尿病是长期的医学问题,包括肾病(肾脏疾病)、神经病变(神经损伤)、视网膜病变、心血管疾病、周围血管疾病、中风和牙周异常(Farag & Gaballa 2011年)。
从1980年到2014年,全球糖尿病患者数量从1.08亿上升到4.22亿。此外,国际上每年有160万人死于糖尿病(世卫组织2020年b)。此外,一些估计数显示,未诊断病例的数量从24.1%到高达75.1%不等,其中估计有83.8%来自低收入和中等收入国家(Beagley et al. 2014)。
与肥胖一样,两者之间的关系糖尿病炎症既复杂又迷人。
糖尿病
研究人员发现轻度炎症与2型糖尿病的发展之间存在关联(Schmidt & Duncan 2003)。以促炎细胞因子升高为特征的慢性炎症可诱发导致2型糖尿病的变化(Keane et al. 2015)。Schmidt和Duncan观察到白细胞计数升高是糖尿病最一致的生物标志物。白细胞(攻击外来物质和疾病的白细胞)是人体防御疾病的主要组成部分。c反应蛋白水平升高是另一种炎症标志物,一直被发现可以预测糖尿病的发病。
糖尿病低度炎症的加剧机制是复杂的;然而,这一过程主要始于营养过剩(高碳水化合物、高脂肪饮食)(Keane et al. 2015)(见下文“肥胖诱发糖尿病的发展[糖尿病]”)。
Farag & Gaballa指出,2型糖尿病患者更有可能出现不同程度的抑郁症,研究表明,这种风险比没有糖尿病的人高出三倍。了解这些数据后,Farag & Gaballa建议对人们进行筛查抑郁症在糖尿病诊断的早期阶段。
Diabesity
Diabesity在科学文献中是一个相对较新的术语。在语境中,它指的是由肥胖引起或与肥胖高度相关的糖尿病。糖尿病有时被称为肥胖依赖型糖尿病(Farag & Gaballa 2011)。
在糖尿病中,慢性营养过剩会诱导“糖水解毒性”状态(Keane et al. 2015)。换句话说,如果饮食中经常充满高碳水化合物(葡萄糖)和脂肪(脂肪),就可能导致有毒的生理状态。糖毒性对机体功能有负面影响线粒体(细胞的能量工厂)(Keane et al. 2015)。在葡萄糖毒性状态下,线粒体的能量产生能力受损,导致潜在的破坏性线粒体副产物称为活性氧分子(也称为自由基)。自由基是不稳定的、高度反应性的分子,可以破坏RNA、DNA和蛋白质。
自由基的积聚会刺激整个体内外周组织以及胰腺中的β细胞(合成和分泌胰岛素的细胞)发生低级别炎症(Keane et al. 2015)。最终,这会导致胰岛素信号通路的脱敏和阻断以及β细胞功能障碍(Keane et al. 2015)。持续暴露于升高的葡萄糖和脂质会阻碍胰腺β细胞分泌胰岛素。
在糖尿病状态下,胰岛素信号通路被炎性细胞因子阻断,抑制肌肉、脂肪和肝脏细胞利用葡萄糖。骨骼肌线粒体细胞尤其受此影响,因为骨骼肌是负责胰岛素刺激葡萄糖处理的主要组织,占葡萄糖摄取的75% (Zierath, Krook & Wallberg-Henriksson 2000)。最终,胰岛素抵抗和长期升高的血糖水平将导致2型糖尿病。
Farag & Gaballa还引用研究表明,慢性压力可能通过激活炎症、自主神经、激素和免疫系统促进糖尿病的发展,并建议有针对性的压力管理应该是糖尿病治疗的基石。
参见:重量训练与糖尿病
炎症和衰老
老化是一个随时间推移的适应过程,由许多与疾病易感性相关和/或负责疾病易感性的生理和遗传因素控制。在个体中,这一过程的速率因生活方式、遗传易感性和导致炎症状态的环境因素而异。
慢性低度炎症是各种与年龄相关的病理的一个因素,包括高血压、肥胖、糖尿病、动脉粥样硬化、癌症等(Sanada et al. 2018)。此外,老化组织的自然过程可能导致由于诸如疾病而丧失活动能力和功能sarcopenia(肌肉损失)和/或骨质疏松症(骨质损失)(Sanada等,2018)。
自由基
影响衰老过程的因素之一是自由基的产生(Liguori et al. 2018)。如前所述,自由基是高度活性的。这是因为它们是原子轨道上有一个未配对电子的分子,这种情况会导致不稳定。自由基可以由正常的细胞代谢产生,也可以由外部来源产生,如污染、香烟烟雾、辐射或药物。
phham - huy, He & Pham-Huy(2008)解释说,当过量的自由基不能被中和时,它们在体内的积累会产生一种现象称为氧化应激(见上文“氧化应激、炎症和衰老的密切关系”)。由于自由基的积累,我们在衰老过程中更容易受到氧化应激的影响。
氧化应激最终开始破坏体内的靶细胞和器官(Pham-Huy, He & Pham-Huy 2008)。这种压力通过激活免疫系统中的巨噬细胞(包围并杀死微生物并清除死亡细胞的白细胞)导致炎症反应(Chung et al. 2019)。巨噬细胞浸润到几乎所有组织(包括肝脏、肌肉、脂肪组织、大脑、肾脏和心脏)的增加可能会在组织水平上引发促炎过程(Chung et al. 2019)。
Oxi-Inflamm-Aging
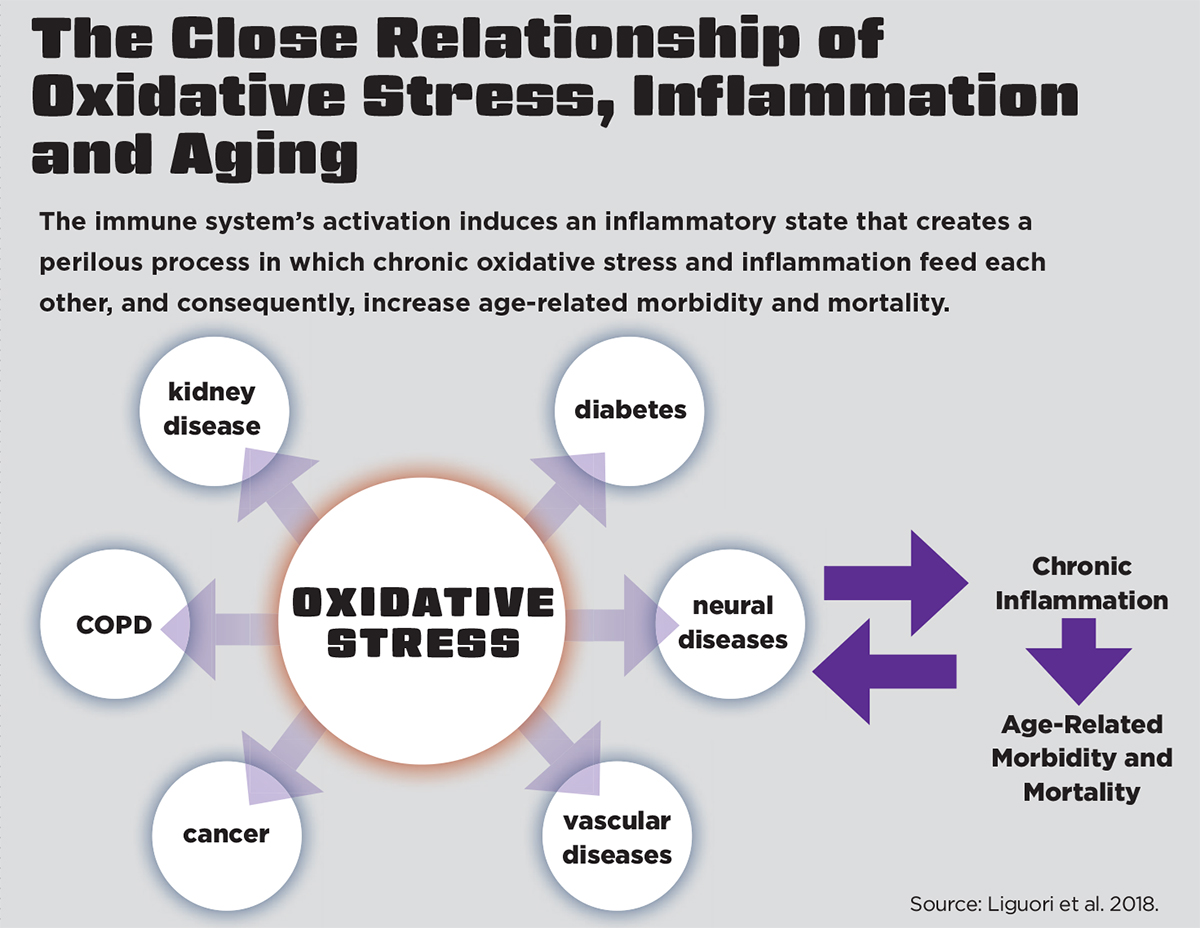
鉴于氧化应激、炎症和衰老之间的密切关系,Liguori等人(2018)提出了衰老的氧化-炎症理论,即“氧化-炎症-衰老”。
他们解释说,衰老是体内平衡的丧失,发生在免疫系统等调节系统经历慢性氧化应激时。免疫系统的激活会诱导炎症状态,从而产生一个不良的循环,在这个循环中,慢性氧化应激和炎症相互作用,增加了与年龄相关的发病率和死亡率的风险。幸运的是,定期的体育活动是对抗氧化应激和由此产生的与年龄相关的炎症破坏的有效策略(Liguori等人,2018年)。
参见:为年迈的客户加油
体育活动如何对抗炎症
常规的体育活动是一种有效的保护和治疗慢性疾病相关的慢性低度炎症。
骨骼肌是人体最大的器官(Pedersen 2007)。运动引起的肌肉收缩会增加一种特定类型的细胞因子的释放myokines。与运动相关的最初和主要细胞因子是白细胞介素-6,它作为运动的反应呈指数增长(Mathur & Pedersen 2008)。
随着运动,IL-6充当能量传感器,并开始提高其产量,与静息水平相比,IL-6可能会增加100倍(Mathur & Pedersen 2008)。运动提高全身循环中IL-6水平的程度与运动的强度、持续时间和数量直接相关肌肉(Pedersen 2007;Lee & Jun 2019)。
Lee & Jun解释说,IL-6还能刺激葡萄糖更新和脂肪酸氧化。此外,随着运动IL-6的增加,会刺激脂肪作为能量的燃料来源。IL-6的升高抑制了TNF-a的产生,并点燃了抗炎细胞因子进入循环的释放(Pedersen 2007)。因此,运动引起的IL-6的升高可能有助于抵消TNF-a在血管炎症、胰岛素抵抗和2型糖尿病中的作用(Pedersen 2007)。
有氧运动
尼曼(2003)指出,运动免疫学研究中出现的最重要的发现是,每次适度的体育活动都会发生积极的免疫变化。他指出,这意味着患普通感冒和其他上呼吸道感染的天数减少了。当研究人员比较低强度运动和中等强度运动的效果时,他们发现中等强度运动在控制低度炎症方面更成功(Krause et al. 2014)。
一项针对男性和女性稳定型冠心病患者的研究表明,绿茶具有抗炎作用有氧运动可以通过多种方式来实现。例如,研究人员发现,在跑步机、固定自行车、臂式自行车、划船机等设备上进行中等强度的有氧运动,每周3天,每次45分钟,持续12周,可以有效降低几种促炎蛋白的基础水平,并增加抗炎细胞因子(Goldhammer et al. 2005)。
对于以前久坐不动的人,有氧运动的强度可以在几个月的时间内逐渐从低到中等,并可以对低度炎症产生类似的非常积极的影响(Kohut et al. 2006)。
为了免疫系统的健康,不鼓励长时间的高强度运动。文献表明,免疫系统的许多组成部分在持续超过90分钟的长时间高强度运动后显示出不利的变化(Nieman 2003)。
关于减少自由基和氧化应激的产生和增加抗氧化剂的水平(中和自由基),有证据表明,对于老年人来说,耐力锻炼的量为VO的50%-80%2每周最多2-3天是最佳的(Liguori等人,2018年)。
抵抗运动
作为健康的重要组成部分,阻力训练提供与健康相关的益处,如改善2型糖尿病患者的代谢状况,增加肌肉质量以减缓肌肉减少症的进展,增加骨密度以预防糖尿病骨质疏松症以及身体成分的整体改善(Calle & Fernandez 2010)。
抗阻训练包括三种肌肉收缩:偏心收缩、等距收缩和同心收缩。偏心,或延长,阶段往往引起最大的肌肉损伤。这种组织损伤引发炎症反应,刺激细胞因子的释放。从到达受损组织的白细胞级联,产生自由基,导致进一步的组织损伤和合成更多的细胞因子(Calle & Fernandez 2010)。这会导致肌肉酸痛和肿胀,但最终也会导致组织修复和重塑(Calle & Fernandez 2010;Izquierdo et al. 2009)。此外,生长中的肌肉纤维产生的IL-6可作为卫星细胞介导的肌肉肥大的调节因子(Izquierdo et al. 2009)。
阻力运动规划(强度、量和休息间隔)也会影响炎症反应。一次发作会增加细胞因子的数量;然而,长期训练的适应性会导致细胞因子的减少,并转向抗炎反应(Calle & Fernandez 2010)。
在大多数研究抗阻训练对炎症影响的研究中,研究对象都是老年男性和女性。Liguori等人总结说,抗抗训练可以提高老年人的抗氧化防御能力,有助于中和自由基和氧化应激。
当训练方案使用中等强度的负荷,并为每个肌肉群提供足够的运动量(练习次数、频率和持续时间)(3-5组,重复10次)时,就可以达到这种积极的效果。Sardeli等人(2018)一致认为,中等强度抗炎训练方案的高容量锻炼似乎在其抗炎效果中发挥积极作用。

最终回顾:8个关键要点
- 急性炎症的常见诱因是感染和组织损伤。
- 有强有力的证据表明,慢性炎症途径对一些慢性疾病的发展起决定性作用。
- 肥胖会导致由脂肪细胞产生的免疫细胞的组成和数量的改变。结果是与胰岛素抵抗和2型糖尿病相关的低度炎症。与皮下脂肪相比,内脏脂肪中的炎症升高。
- 慢性压力可能通过激活炎症、自主神经、激素和免疫系统促进糖尿病(肥胖诱发糖尿病)的发展。
- 患有糖尿病的人患抑郁症的可能性是没有糖尿病的人的三倍多。
- 运动引起的肌肉收缩会增加一种特定炎症蛋白的释放,有助于对抗胰岛素抵抗和2型糖尿病。
- 相对于一个人的健康水平,中等强度的有氧运动在管理慢性低度炎症方面比低强度的有氧运动更有效。剧烈运动导致更大的氧化应激,从而增强身体的炎症反应。
- 更大的音量阻力训练方案(更多的锻炼,更大的干预频率和持续时间)似乎在对抗炎症方面发挥了积极作用。
COVID-19和炎症
慢性炎症是糖尿病、肥胖和高血压等疾病的一个因素——所有这些都出现在许多因COVID-19住院的患者身上。COVID-19的一个显著特点是,它有能力引起如此多不同的症状,进一步混淆人体的免疫系统。因此,在慢性炎症期间发生的病毒感染会使身体的免疫系统持续超负荷。
参考文献
Beagley, J.等,2014。成人未确诊糖尿病的全球估计。糖尿病研究与临床实践,103(2), 150 - 60。
Boutens, L., & Stienstra, R. 2016。脂肪组织巨噬细胞:肥胖期间偏离轨道。Diabetologia, 59岁(5), 879 - 94。
Calle, m.c., & Fernandez, M.L. 2010。抗阻训练对炎症反应的影响。营养学研究与实践,4(4), 259 - 69。
陈,L.,等。2018。器官的炎症反应和炎症相关疾病。Oncotarget 9(6), 7204 - 18。
钟,H.Y,等。2019。重新定义衰老和年龄相关疾病中的慢性炎症:老年炎症概念的提出。衰老与疾病,10(2), 367 - 82。
Ellulu, m.s.,等。2017。肥胖与炎症:相关机制及并发症。医学科学档案,13(4), 851 - 63。
Farag, Y.M.K, & Gaballa, M.R. 2011。糖尿病:一种不断上升的流行病的概述。肾透析移植,26(1) 28-35。
小费兰特,2007。肥胖引起的炎症:炎症语言中的代谢对话。内科杂志,262(4), 408 - 14所示。
Goldhammer, E., et al. 2005。运动训练调节冠心病患者细胞因子活性国际心脏病杂志,100(1), 93 - 99。
Izquierdo, M., et al. 2009。抗阻训练对细胞因子和激素的反应。欧洲应用生理学杂志,107(4), 397 - 409。
基恩,k.n.等。2015。将氧化应激和炎症与胰岛素抵抗和b细胞功能障碍联系起来的分子事件。氧化医学与细胞寿命doi: 10.1155 / 2015/181643。
科胡特,m.l.等,2006。在老年人中,有氧运动,而不是柔韧性/阻力运动,可以降低血清IL-18、CRP和IL-6,而不受b-阻滞剂、BMI和心理社会因素的影响。大脑、行为和免疫,20(3), 201 - 9。
克劳斯,M.等,2014。两种不同强度的有氧运动训练对肥胖和2型糖尿病的影响:对氧化应激、低度炎症和一氧化氮产生的影响。欧洲应用生理学杂志,114(2), 251 - 60。
Lee, j.h., & Jun, H.S. 2019。肌素在调节骨骼肌质量和功能中的作用。生理学前沿,10,42.
Libby, P. 2007。炎症机制:炎症和疾病的分子基础。营养评论,65(12), S140-46。
Liguori, I.,等。2018。氧化应激、衰老和疾病。衰老的临床干预,13,757 - 72。
马瑟,N., &佩德森,B.K. 2008。运动是控制低度全身炎症的一种手段。炎症介质,doi: 10.1155 / 2008/109502。
麦哲托夫,R. 2008。炎症的起源和生理作用。自然,454,428 - 35。
尼曼,华盛顿特区,2003年。运动免疫学的研究现状。当前运动医学报告,2(5), 239 - 42。
Pedersen, B.K. 2007。最新综述:运动对慢性低度全身炎症患者的健康益处。美国生活方式医学杂志,1(4), 289 - 98。
Pham-Huy,洛杉矶,He, H., & Pham-Huy, C. 2008。自由基,疾病和健康的抗氧化剂国际生物医学杂志,4(2), 89 - 96。
Sanada, F.,等。2018。衰老中慢性炎症的来源。心血管医学前沿,5(12)。
萨德利,a.v.,等。2018。抗阻训练对老年人炎症标志物的影响:一项荟萃分析。实验老年学,111,188 - 96。
施密特,m.i.,和邓肯,B.B. 2003。糖尿病:一种炎症性代谢状况。临床化学与检验医学,41(9), 1120 - 30。
卫生组织(世界卫生组织)。2020 a。肥胖和超重。2020年10月24日访问:
. int /新闻/说明书/细节/肥胖和超重。
谁。2020 b。糖尿病2020年11月7日访问:who.int/news-room/fact-sheets/detail/diabetes。
齐拉斯,J.R.,克鲁克,A.,沃伯格-亨利克森,H. 2000。胰岛素在人体骨骼肌中的作用和胰岛素抵抗。Diabetologia, 43岁(7), 821 - 35。
相关文章
广告








